国产自拍

8743
1112

4847
8846

4142
1804

9148
25

6873
9884

2756
5182

6810
5806

2841
2417

4130
2901

8067
9557

7648
8299

7357
3146

6722
7284

6399
6431

3954
3304

8254
6056

2166
2866

2094
5702

9348
9827
中文字幕
无码专区

5044
4992

6960
1825

6769
7677

362
4488

2087
1427

5915
4456
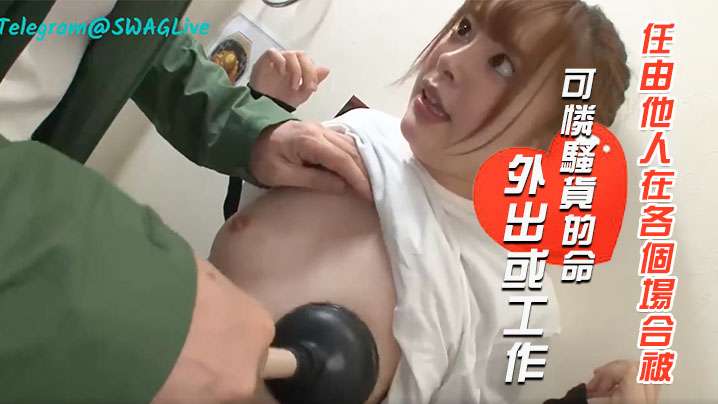
7960
1017

385
3967

5274
9006

1981
5965

3466
2734

4212
4848

1319
5206

3354
3422

2153
5504

2838
1419

3703
9374
丝袜美腿

6702
5028

9124
470

8921
4677

9567
5992

4701
9341

5699
1494

2887
9413

4739
6115

5596
3117

1969
1161

5964
5424

8982
1122

7504
9238